¿Cuándo se debe realizar una punción medular y por qué?
¿Qué es la punción medular?
Una punción medular, o punción de médula ósea, consiste en la introducción de una aguja fina, con trocar, en la cavidad de la médula ósea, realizando un aspirado para extraer el tejido que forma la sangre (hematopoyético). En la figura 1 se esquematizan las principales operaciones que intervienen en este proceso.
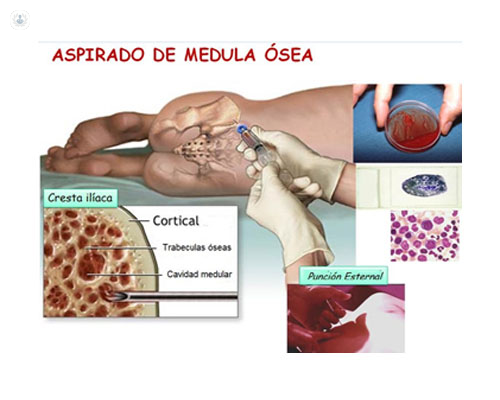
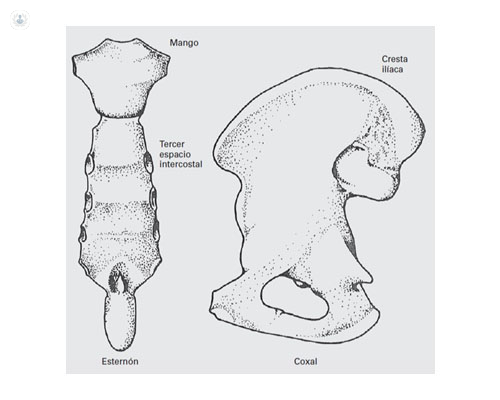
La punción medular suele hacerse en el esternón (mango o 3r espacio intercostal) y se conoce como “punción esternal” (figura 2), pero también puede hacerse en la cresta ilíaca.
¿Cómo se selecciona la sangre y qué puede analizarse?
Una vez hecha la extracción se deben seleccionar los grumos medulares (partes de color blanco) que están mezclados con la sangre en la placa de Petri. Con el canto de un portaobjetos se hacen varias extensiones no muy gruesas sobre otro que, cuando estén bien secas, se teñirán para observar las células en el microscopio.
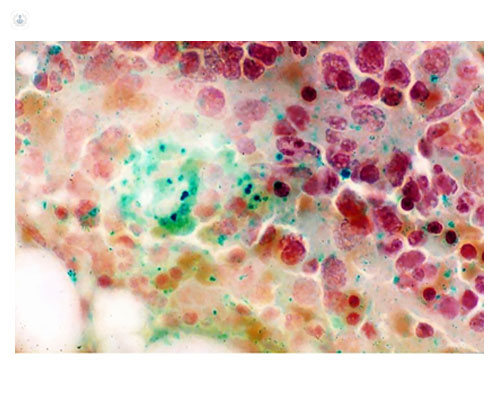
Normalmente se utiliza el tinte May-Gründwald-Giemsa (MGG) pero si, además, el especialista en Hematología quiere conocer el estado de los depósitos de hierro en el cuerpo y confirmar si hay ferropenia (falta de hierro), puede hacerse una tinción de Pearls, que teñirá de azul-verde el hierro que hay almacenado en la médula ósea (figura 3).
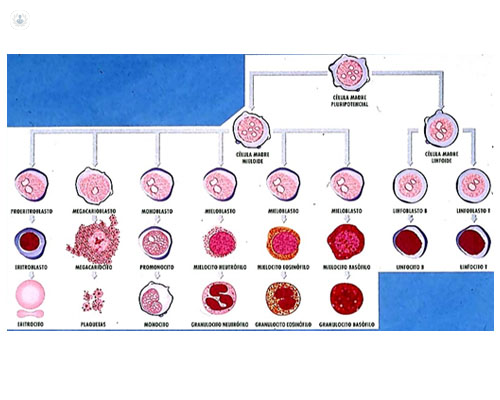
La tinción de MGG permite observar morfológicamente las células que forman la sangre o células de la hematopoyesis. Todas las células de la sangre proceden de una única célula, la “célula madre pluripotente” o “stem-cell” que, mediante distintos procesos de diferenciación, dará lugar a 2 grandes líneas madurativas: mieloide y linfoide, con sus correspondientes precursores. Estos, a través de una maduración progresiva, se transformarán en células maduras: leucocitos (granulocitos, linfocitos y monocitos), hematíes y plaquetas (figura 4).
¿Cuándo se indica la punción medular?
Las principales causas que aconsejan realizar una punción medular se resumen a continuación:
- Anemia perniciosa (anemia arregenerativa)
- Anemia refractaria (mielodisplasia)
- Enfermedad de Gaucher (tesaurismosis)
- Eritroblastopenia (timoma)
- Gammapatía monoclonal de significado incierto (MGUS)
- Hemólisis (anemia regenerativa)
- Histiocitosis maligna (HM)
- Inmunodeficiencia adquirida (SIDA)
- Leishmaniasis visceral (Kala-azar)
- Leucemia mieloide crónica (LMC)
- Leucemia linfática crónica (LLC)
- Leucemia aguda mieloide (LAM)
- Leucemia aguda linfoide (LAL)
- Linfoma
- Mielofibrosis idiopática (MI)
- Mieloma múltiple
- Metástasis carcinomatosa de la médula ósea
- Policectomía vera (PV)
- Síndrome inflamatorio crónico
- Trombocitemia esencial (TE)
Lo anteriormente mencionado corresponde a las siguientes situaciones clínicas:
- Anemia de diagnóstico incierto. La anemia o disminución de la concentración de hemoglobina en sangre es una de las causas para practicar una punción medular. La mayoría de veces la anemia se debe a una falta de hierro (anemia ferropénica) o a una falta de vitaminas (anemia megaloblástica). En ambos casos un hemograma facilitará el diagnóstico con la variación de Volumen Corpuscular Medio (VCM) de los hematíes. Así, si hay una disminución (VCM<83fl) se sospechará de una anemia por falta de hierro. En cambio, un aumento orientará hacia una falta de vitaminas. A parte de estas situaciones, que son más frecuentes, existen más enfermedades que se acompañan de anemia y cuyo diagnóstico puede ser difícil por una falta de orientación clínica. En estos casos hay una prueba que permite una primera orientación diagnóstica, el recuento de reticulocitos: su número indica la capacidad que tiene la médula ósea para reaccionar ante la anemia. Si la anemia cursa con aumento de reticulocitos significa que la médula ósea funciona bien (anemia regenerativa), mientras que, si cursa con reticulocitos normales o disminuidos, significa que la médula no funciona como debería (anemia arregenerativa). Ante una anemia de estas características, si no hay otros indicadores de orientación etiológica (como el VCM), podría estar indicado realizar una punción medular. Por otra parte, la edad es un factor que puede contribuir en la recomendación de llevar a cabo una punción medular o no. En personas mayores de 60 años no es poco frecuente que aparezca anemia de causa desconocida y que, la mayoría de las veces, obedezca a un síndrome mielodisplásico o un proceso inflamatorio crónico, en muchas ocasiones de origen indeterminado (anemia inflamatoria).
- Alteración de las células de la sangre de origen desconocido. Se puede indicar punción medular si existen alteraciones significativas del hemograma, sin causas secundarias. Un ejemplo son las variaciones del número de células de la sangre que afectan a una o diversas líneas celulares: disminuciones persistentes de granulocitos (leucopenia: <0,5 x 109/l) o de plaquetas (trombopenia: <20 x 109/l) o aumentos persistentes y/o progresivos del número de leucocitos (leucocitosis: >11 x 109/l) o plaquetas (trombocitosis: >350 x 109/l). Normalmente estas alteraciones de la sangre son reacciones de la médula ósea a un estímulo externo, la mayoría de veces sin importancia pero, en otros casos, pueden obedecer a una enfermedad de la médula ósea o hemopatía. En tal caso es esencial hacer una punción medular para observar su estado. Entre las hemopatías malignas destacan los síndromes mieloproliferativos y linfoproliferativos (leucemia mieloide crónica, leucemia linfática crónica y linfomas) y las leucemias agudas (mieloblásticas y linfoblásticas).
- Pancitopenia grave o descenso de todas las células de la sangre. Esto puede ser un primer signo de enfermedad grave de la sangre e indicación de punción medular. En algunos pacientes con pancitopenia es imposible tener suficiente material de médula ósea para hacer un examen morfológico, punción blanca o “dry-tap” (en inglés). En tal caso se podrá intentar hacer una nueva punción medular en otro lugar del esternón o cresta ilíaca pero, si se vuelve a hacer la punción blanca, deberá hacerse una biopsia ósea. Se trata de un examen histológico de la médula que, a diferencia del aspirado, ofrece una visión de la estructura del hueso, y permite apreciar la celularidad real y también la posible presencia de células extra hematológicas (metástasis). Con la biopsia, pues, puede diferenciarse el diagnóstico entre aplasia de médula ósea (desaparición de células formadoras de sangre, sustituyéndose por células grasas) y mielofibrosis idiopática o degeneración fibrosa de las cavidades de la médula ósea, desapareciendo la hematopoyesis normal. A veces una punción blanca obedece a una invasión no absoluta de las cavidades de la médula por células leucémicas que, a causa de su empaquetamiento, no pueden ser aspiradas con punción medular. En tales casos solo la biopsia ósea permitirá hacer un diagnóstico de leucemia aguda con leucemia aleucémica o pancitopenia.
- Gammapatía monoclonal. Es la aparición de un pico en las gammaglobulinas del proteinograma. Esto significa una alteración de la electroforesis sérica (banda monoclonal) y es una indicación de punción medular para descartar que exista mieloma múltiple o cáncer de células plasmáticas. El hecho de que, a partir de los 70 años, un 5% de personas sufra una gammapatía monoclonal de significado incierto (MGUS) es, junto a los síndromes mielodisplásicos (SMD), una causa bastante frecuente de punción medular en personas de edad avanzada.
- Esplenomegalia o aumento del tamaño del bazo. Suele deberse a distintas causas pero, si aparece, debe pensarse en una hemopatía. Hay dos causas poco frecuentes pero que, muchas veces, son diagnosticadas con punción medular. Una es la leishmaniasis visceral o enfermedad parasitaria transmitida por perros que provoca un cúmulo de parásitos en médula ósea y bazo. Otra es la enfermedad de Gaucher, por un trastorno metabólico, que causa un cúmulo de depósitos grasos en distintos tejidos, sobre todo en el bazo.
Preparación necesaria para una punción medular
La punción medular no precisa de preparación especial. Solamente es necesaria una camilla para poder extender al paciente boca arriba (punción en el esternón) o boca abajo (punción en la cresta ilíaca). Se recomienda realizar la prueba en ayunas, por si el paciente tiene algún pequeño mareo al reincorporarse tras la intervención.
Aunque, en principio, la entrada de la aguja en la cavidad de la médula no produce dolor, sí es dolorosa la penetración en el periostio, por lo que se administra un anestésico local por vía subcutánea. Para realizar la punción se emplea una aguja fina con trocar y, para el aspirado, una jeringa de 2 a 10cm.
Cuidados tras una punción medular
No son necesarios cuidados especiales tras la punción medular, excepto en pacientes que tengan un número bajo de plaquetas (plaquetopenia), donde debe haber precauciones, por si hubiera una pequeña hemorragia (hematoma subcutáneo) tras la punción.
Alternativas a la punción medular
La punción medular no es un tratamiento, sino un procedimiento diagnóstico. Por ahora, de la misma manera que no existe otra técnica para observar las células sanguíneas que la punción venosa, no hay un método sustitutivo que permita observar las células de la médula ósea sin una punción en el hueso.









